Grundlagen der Dampftechnik und Wärmeübertragung

Inhalt
Entropie – Grundverständnis
Entropie ist ein Konzept, das für manche schwer zu begreifen ist, aber in Wahrheit verdient es diese Berühmtheit nicht. Betrachten Sie die Entropie als eine Straßenkarte, die thermodynamische Situationen miteinander verbindet. Dieser Lehrgang soll etwas Licht auf dieses Thema werfen, indem er sich ihm von den ersten Prinzipien her nähert.
Was ist Entropie?
Eigentlich ist es einfacher zu sagen, was Entropie nicht ist. Es ist keine physikalische Eigenschaft des Dampfes wie Druck, Temperatur oder Masse. Ein Messfühler kann sie nicht erfassen und sie wird nicht an einem Manometer angezeigt. Sie muss im Gegenteil aus Werten berechnet werden, die gemessen werden können. Die Entropiewerte können dann aufgelistet und in Berechnungen verwendet werden; insbesondere Berechnungen, welche mit dem Dampfmassenstrom und der Energieerzeugung mit Hilfe von Turbinen oder Kolbenmotoren zu tun haben.
Sie ist in gewisser Weise ein Maß für die mangelnde Qualität oder Verfügbarkeit von Energie, und inwieweit Energie immer dazu strebt, sich von einer Quelle mit hoher Temperatur auf größere Bereiche mit niedrigerem Temperaturniveau auszubreiten. Dieser Zwang, sich zu auszubreiten, hat einige Betrachter dazu veranlasst, die Entropie als „Zeitpfeil“ zu bezeichnen. Wenn die Entropie eines Systems bei zwei unterschiedlichen Zuständen berechnet wird, dann tritt der Zustand, in welchem die Entropie höher ist, zu einem späteren Zeitpunkt ein. Die Zunahme der Entropie in einem Gesamtsystem findet immer in der gleichen Richtung statt, in der die Zeit vergeht.
Das hat vielleicht einen gewissen philosophische Ansatz, hilft aber nicht viel bei der Berechnung tatsächlicher Werte. Ein etwas genauerer Ansatz ist es, Entropie als die Energie zu definieren, die einem System zugeführt oder entzogen wird, dividiert durch die mittlere absolute Temperatur, über die die Änderung stattfindet.
Um zu sehen, wie dies funktioniert, ist es vielleicht das Beste, mit einem Diagramm zu beginnen, welches zeigt, wie der Enthalpiegehalt eines Kilogramms Wassers ansteigt, wenn es bei unterschiedlichen Drücken erwärmt und zu Dampf umgewandelt wird. Da die Temperatur und der Druck, bei welchem Wasser siedet, in einem festem Zusammenhang zueinander stehen, könnte Abbildung 2.15.1 auch so dargestellt werden, dass die Enthalpie über der Temperatur dargestellt wird, und dann so gedreht werden, dass die Temperatur die vertikale Achse über der Basis Enthalpie wird, wie in Abbildung 2.15.2 dargestellt

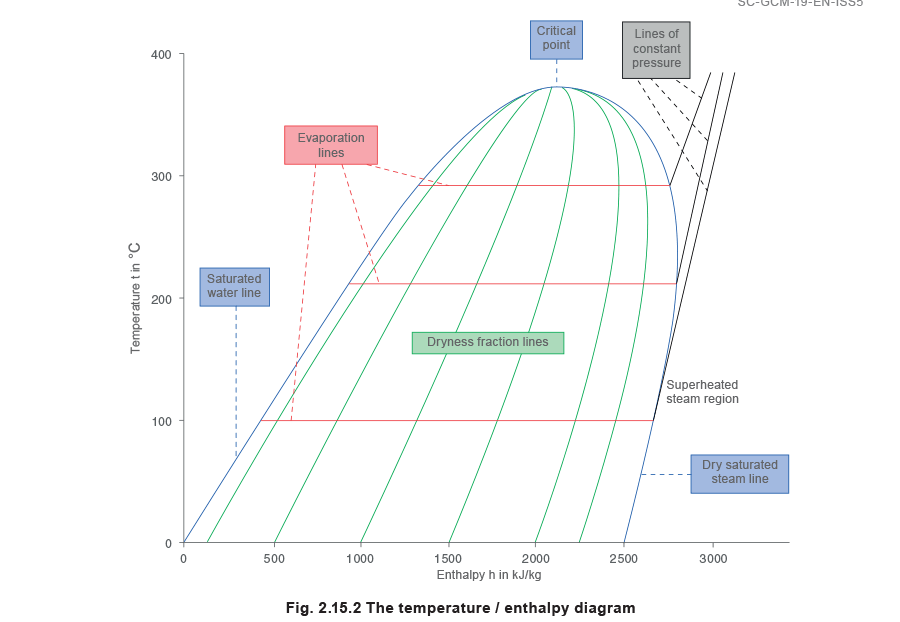
Die Linien konstanten Drucks entspringen aus der Sättigungslinie Wasser. Der horizontale Abstand zwischen der Sättigungslinie Wasser und der Linie für trockenen gesättigten Dampf gibt die Menge an latenter Wärme oder Verdampfungsenthalpie wieder und wird Verdampfungslinie genannt (die Verdampfungsenthalpie nimmt mit steigendem Druck ab). Der Bereich rechts neben der Linie für trockenen gesättigten Dampf ist die Zone für überhitzten Dampf, und die Linien konstanten Druckes verlaufen jetzt nach oben, sobald sie die Linie für trockenen gesättigten Dampf geschnitten haben.
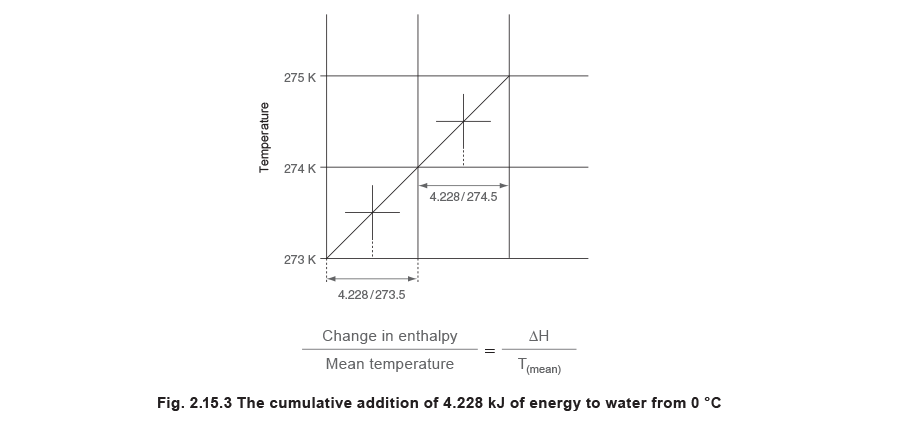
Eine Abwandlung des Diagramms in Abbildung 2.15.2 kann sehr hilfreich sein und ist jenes, in dem die horizontale Achse nicht die Enthalpie sondern stattdessen die Enthalpie geteilt durch die mittlere Temperatur, bei welcher Enthalpie zu- oder abgeführt wird, ist. Um ein solches Diagramm zu erstellen, können Enthalpiewerte berechnet werden. Das Diagramm wird dann so gezeichnet, dass man am Ursprung des Diagramms bei einer Temperatur von 0 °C und atmosphärischem Druck beginnt und Enthalpie in kleinen Mengen hinzuaddiert. Da die Entropie in Bezug auf die absoluter Temperatur gemessen wird, ist die Anfangstemperatur von 0 °C mit 273,15 K anzusetzen. Die spezifische Wärmekapazität von gesättigtem Wasser bei dieser Temperatur beträgt 4,228 kJ/kg K. Um das Diagramm in Abbildung 2.15.3 zu konstruieren, wird eine Ausgangstemperatur von 273 K und nicht 273,15 K angenommen.
Ausgehend von einem Kilogramm Wasser bei Atmosphärendruck, dem 4,228 kJ Energie zugeführt werden, würde die Wassertemperatur um 1 K von 273 auf 274 K ansteigen. Die mittlere Temperatur während dieses Vorgangs beträgt 273,5 K, siehe Abbildung 2.15.3.
Dieser Wert spiegelt die Enthalpieänderung je Grad Temperaturanstieg für ein Kilogramm wieder und wird als spezifische Entropieänderung bezeichnet. Die metrische Einheit für die spezifische Entropie ist daher kJ/kg K.
Dieser Prozess kann dadurch fortgeführt werden, dass weitere 4,228 kJ an Energie zugeführt werden, um eine Reihe dieser Punkte auf einer Zustandslinie zu bilden. Bei der nächsten Erhöhung würde die Temperatur von 274 K auf 275 K steigen und die mittlere Temperatur 274,5 K betragen.

Aus diesen einfachen Berechnungen wird deutlich, dass wenn die Temperatur ansteigt, sich die Entropieänderung für jede gleiche Enthalpieerhöhung leicht reduziert. Wenn dieser stufenweise Prozess durch weitere Energiezugabe kontinuierlich wiederholt werden würde, könnte man feststellen, dass die Entropie weiterhin abnehmen wird. Das liegt daran, dass jede weitere zusätzliche Erhöhung der Energie die Temperatur ansteigen lässt, und somit die Breite der Streifen, die diese darstellt, verringert. Je mehr Wärme zugeführt wird, umso mehr krümmt sich die Zustandslinie, in diesem Fall die Linie für gesättigtes Wasser, leicht nach oben.
Bei 373,14 K (99,99 °C) ist der Siedepunkt von Wasser bei Atmosphärendruck erreicht und bei weiterer Energiezufuhr beginnt ein Teil des Wasser bei konstanter Temperatur zu verdampfen. An diesem Punkt beginnt die Zustandslinie horizontal nach rechts im Diagramm zu verlaufen, und das zeigt sich in Abbildung 2.15.4 in der horizontalen Verdampfungslinie, die sich von der Linie des gesättigten Wassers zur Sattdampflinie erstreckt. Da es sich dabei um einen Verdampfungsprozess handelt, wird diese zugeführte Energie als Verdampfungsenthalpie bezeichnet.
Die Dampftafel gibt an, dass bei Atmosphärendruck die zuzuführende Energie, um 1 kg Wasser in Dampf umzuwandeln, 2 256,71 kJ beträgt. Da dies bei einer konstanten Temperatur von 373,14 K geschieht, beträgt die mittlere Temperatur der Verdampfungslinie ebenfalls 373,14 K.
Die spezifische Entropieänderung von der Linie des gesättigten Wassers zur Sattdampflinie beträgt daher:

Das entstehende Diagramm, welches die Temperatur über der Entropie darstellt, würde etwa wie in Abbildung 2.15.4 aussehen, wobei
- 1 die Linie für gesättigtes Wasser ist,
- 2 die Sattdampflinie ist,
- 3 die Linien für konstante Trockenheitsgrade im Nassdampfbereich sind,
- 4 die Linien konstanten Drucks im Überhitzungsbereich sind.

Welchen Nutzen hat das Temperatur-Entropie-Diagramm (oder T-S-Diagramm)?
Eine mögliche Verwendung des T-S-Diagramms ist es, den Dampfzustand bei Prozessen nachzuvollziehen, bei denen zwischen Anfangs- und Endzustand des Prozesses keine Änderung der Entropie auftritt. Solche Prozesse nennt man isentrop (konstante Entropie).
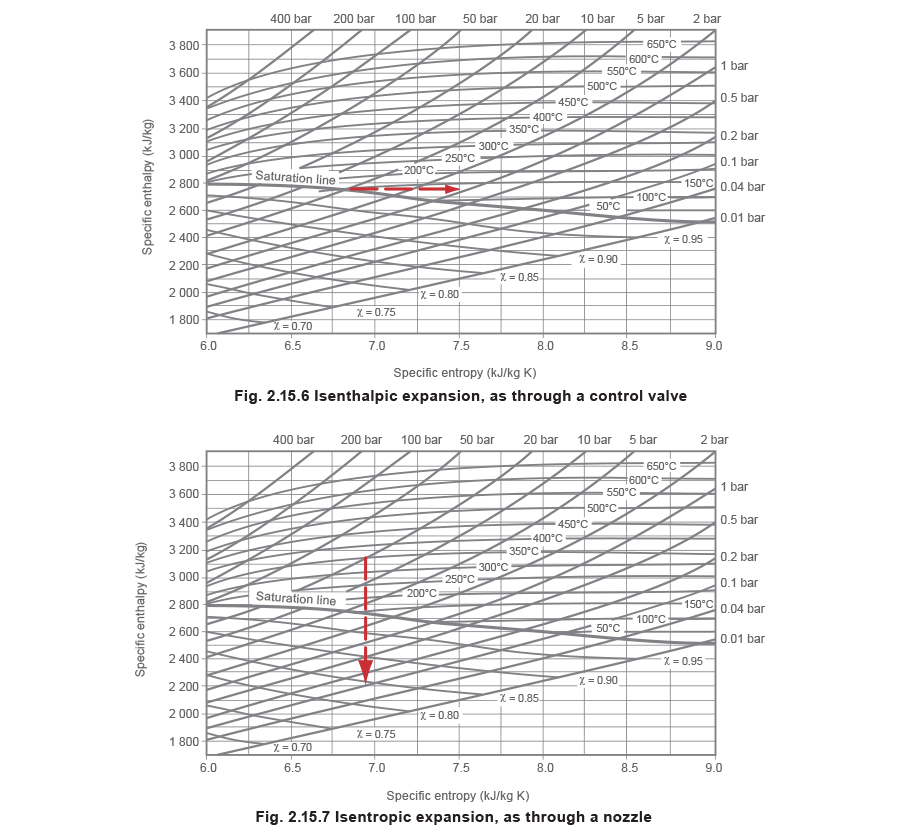
Leider sind die im T-S-Diagramm dargestellten Linien für konstante Gesamtenergie gekrümmt, was es schwierig macht, solche freien und uneingeschränkten Ausdehnungen, wie diejenigen, bei denen Dampf durch ein Regelventil strömen und sich ausdehnen kann, nachzuvollziehen. Im Falle eines Regelventils, bei dem die Geschwindigkeiten in den zu- und abführenden Leitungen nahezu gleich sind, läuft der gesamte Prozess bei konstanter Enthalpie (isenthalp) ab. Im Falle einer Düse, bei der die Endgeschwindigkeit hoch bleibt, geschieht der gesamte Prozess bei konstanter Entropie.
Um diese unterschiedlichen Prozesse nachzuvollziehen, kann ein Diagramm mit Drücken und Temperaturen erstellt werden, welches auf der horizontalen Achse die Entropie und auf der vertikalen Achse die Enthalpie darstellt und welches das Enthalpie-Entropie-Diagramm oder H-S-Diagramm genannt wird; siehe Abbildung 2.15.5.

Das H-S-Diagramm wird auch Mollier-Diagramm oder Mollier-Schaubild genannt und ist nach Dr. Richard Mollier aus Dresden benannt, der 1904 als Erster die Idee für ein solches Diagramm hatte.
Hier wird nun die isenthalpe Expansion von Dampf durch ein Regelventil durch eine gerade horizontale Linie dargestellt, die vom Ausgangszustand zum geringeren Enddruck auf der rechten Seite des Diagramms verläuft (siehe Abbildung 2.15.6), und die isentrope Expansion von Dampf durch eine Düse ist einfach eine Linie, die vom Ausgangszustand vertikal nach unten zum geringeren Enddruck verläuft (siehe Abbildung 2.15.7).
Eine isentrope Expansion von Dampf ist immer mit einer Abnahme der Enthalpie verbunden, und das wird der „Wärmeabfall“ (H) zwischen dem Anfangs- und Endzustand genannt. Die H-Werte können einfach an den Anfangs- und Endpunkten auf dem Mollier-Diagramm abgelesen werden, und deren Differenz ergibt den Wärmeabfall. Die Genauigkeit des Diagramms ist für die meisten praktischen Anwendungen ausreichend.
Ein interessanter Punkt ist, dass die Expansion über ein Regelventilsitz ein isenthalper Prozess ist, und man geht davon aus, dass sich der Ausgangspunkt direkt nach rechts verschiebt, wie in Abbildung 2.15.6 dargestellt. In Wirklichkeit geschieht das nicht so direkt. Damit sich der Dampf durch die schmale Engstelle zwängen kann, muss er seine Geschwindigkeit erhöhen. Das macht er dadurch, dass er sich Energie von seiner Enthalpie „borgt“ und sie in kinetische Energie umwandelt. Es entsteht ein Wärmeabfall. Dieser Teil des Prozesses ist isentrop, der Anfangspunkt wandert vertikal nach unten zu einem niedrigeren Druck.
Nachdem er die schmale Verengung passiert hat, expandiert der Dampf in einen Bereich niedrigeren Druckes im Ventilaustritt und wird wahrscheinlich langsamer, da das Volumen des Ventilkörpers zunimmt, um mit der Austrittsleitung verbunden werden zu können. Diese Geschwindigkeitsabfall erfordert eine Abnahme der kinetischen Energie, welche größtenteils wieder in Wärme umgewandelt und vom Dampf aufgenommen wird. Der Wärmeabfall, der den anfänglichen Anstieg der kinetische Energie verursacht hat, wird rückgewonnen (mit Ausnahme eines kleine Anteils, welcher auf Grund von Reibung verloren gegangen ist), und im H-S-Diagramm wandert der Zustandspunkt entlang der Linie konstanten Drucks nach oben, bis er den gleichen Enthalpiewert wie beim Ausgangszustand erreicht hat.
Der Weg des Zustandspunkts ist in Abbildung 2.15.8 dargestellt, wobei der Druck, zum Beispiel über ein Druckreduzierventil, von 5 bar abs bei Sattdampftemperatur auf 1 bar abs reduziert wird. Die Enthalpie des Dampfes im stromaufwärtigen Zustand bei 5 bar abs beträgt 2 748 kJ/kg.

Es ist interessant festzustellen, dass in dem genannten und in Abbildung 2.15.8 dargestellten Beispiel der Endzustand des Dampfes oberhalb der Sattdampflinie liegt und damit überhitzt ist. Immer wenn ein solcher Prozess (allgemein Drosselprozess genannt) stattfindet, wird der Endzustand des Dampfes in den meisten Fällen trockener sein als im Ausgangszustand. Das erzeugt entweder trockeneren oder überhitzten Dampf, abhängig von den entsprechenden Positionen der Anfangs- und Endpunkte. Die horizontale Strecke zwischen dem Anfangs- und Endpunkt gibt die Änderung der Entropie wieder.
Obwohl es in diesem Beispiel keine Gesamtänderung der Enthalpie gegeben hat (wenn die geringen Auswirkungen der Reibung nicht in Betracht gezogen werden), ist die Entropie von ungefähr 6,8 kJ/ kg K auf ungefähr 7,6 kJ/kg K angestiegen.
Die Entropie in einem geschlossenen System nimmt immer zu
In jedem geschlossenen System ist die Gesamtänderung der Entropie immer positiv, was der Grund dafür ist, dass sie immer zunimmt. Es lohnt sich, dies tiefgehender zu betrachten, da es für das Verständnis der Entropie wichtig ist. Während Energie immer erhalten bleibt (der erste Hauptsatz der Thermodynamik besagt, dass Energie nicht gebildet oder vernichtet werden kann), kann das über die Entropie nicht immer gesagt werden. Der zweite Hauptsatz der Thermodynamik besagt, dass immer wenn Energie von einer Form in eine andere ausgetauscht oder umgewandelt wird, das Potential der Energie zur Verrichtung von Arbeit geringer wird. Das ist, was Entropie wirklich ist. Sie ist ein Maß für das Fehlen von Potential oder Qualität der Energie, und sobald diese Energie einmal ausgetauscht oder umgewandelt wurde, kann sie nicht mehr auf ihren höheren Zustand zurückkehren. Die letztendliche Wahrheit ist, dass es für alle Prozesse im Universum unumgänglich ist, bei der gleichen Temperatur zu enden, so dass die Entropie des Universums immer zunimmt.
Beispiel 2.15.1
Stellen Sie sich eine Teekanne auf einem Küchentisch vor, die gerade aus einem elektrischen Wasserkocher mit einer bestimmten Menge Wasser, welches eine Energiemenge von 200 kJ bei 100 °C (373 K) beinhaltet, gefüllt wurde. Stellen Sie sich nun vor, dass die Temperatur der Luft, die die Kanne umgibt, 20 °C beträgt, und dass die Energiemenge des Wassers in der Teekanne am Ende des Prozesse 40 kJ ist. Der zweite Hauptsatz der Thermodynamik besagt auch, dass Wärme immer vom wärmeren zum kälteren Körper strömt, und in diesem Beispiel ist es sicher, dass sich die Teekanne nach einer ausreichenden Zeit auf dieselbe Temperatur wie die sie umgebende Luft abkühlen wird. Wie groß sind die Werte für die Entropieänderungen für diesen gesamten Prozess?

Praktische Anwendung - Wärmetauscher
In einem Wärmetauscher, der auf der Primärseite Dampf verwendet, um Wasser von 20 °C auf 60 °C auf der Sekundärseite zu erwärmen, wird der Dampf kondensieren und seine Energie abgeben. Das wird im Mollier-Diagramm dadurch dargestellt, dass der Zustandspunkt von seinem Ausgangspunkt nach links wandert. Bei konstanten Bedingungen kondensiert Sattdampf bei konstantem Druck und der Zustandspunkt des Dampfs wandert entlang der Linie des konstanten Drucks nach unten, wie in Abbildung 2.15.9 dargestellt.
Beispiel 2.15.2
Dieses Beispiel betrachtet Dampf, der vom Sättigungspunkt bei 2 bar ü bei 120 °C mit einer Entropie von 7,13 kJ/kg K und einer Enthalpie von ungefähr 2 700 kJ/kg kondensiert. Man sieht, dass sich der Zustandspunkt von links nach rechts verschiebt, aber nicht horizontal, sondern entlang der Linie konstanten Drucks bei 2 bar. Das Diagramm ist nicht groß genug, um den ganzen Kondensationsprozess darzustellen, aber wenn dem so wäre, würde man sehen, dass der Endzustandspunkt des Dampfs bei einer Entropie von 1,53 kJ/kg K und einer Enthalpie von 504,8 kJ/kg an der Sättigungslinie des Wassers bei 2 bar und 120 °C landet.

Aus Abbildung 2.15.9 ist zu erkennen, dass der Zustandspunkt entlang der Verdampfungslinie nach unten wandert und die Entropie abnimmt, wenn Dampf kondensiert. In jedem Gesamtsystem muss die Entropie jedoch zunehmen, andernfalls würde der zweite Hauptsatz der Thermodynamik verletzt werden; wie kann man also diese Abnahme der Entropie erklären?
Wie bei der Teekanne aus Beispiel 2.15.1 spiegelt diese Entropieabnahme nur das wider, was in einem Teil des System vor sich geht. Man muss immer daran denken, dass jedes Gesamtsystem seine Umgebung mit einschließt, in Beispiel 2.15.2 das Wasser, welches die durch den Dampf weitergegebene Energie aufnimmt.
In Beispiel 2.15.2 nimmt das Wasser genau die gleiche Energiemenge auf, welche der Dampf zuführt (man geht davon aus, dass es keine Wärmeverluste gibt), aber es macht dies bei einer geringeren Temperatur als die des Dampfs; da sich die Entropie aus Enthalpie/Temperatur ergibt, führt eine Division derselben Energiemenge durch eine geringere Temperatur zu einer höheren Entropiezunahme des Wassers als durch den Dampf verloren geht. Daher gibt es eine Gesamtzunahme der Systementropie und eine generelle Energieausbreitung.
Tabelle 2.15.1 Relative Dichten/spezifische Wärmekapazitäten verschiedener Feststoffe
| Material | Relative Dichte | Spezifische Wärmekapazität kJ/kg °C |
| Aluminium | 2.55 - 2.80 | 0.92 |
| Andalusit | 0.71 | |
| Antimon | 0.2 | |
| Apatit | 0.83 | |
| Asbest | 2.10 - 2.80 | 0.83 |
| Augit | 0.79 | |
| Bakelit, Porenfüller | 1.38 | |
| Bakelit, Asbestfüller | 1.59 | |
| Baryt | 4.5 | 0.46 |
| Barium | 3.5 | 2.93 |
| Basaltfels | 2.70 - 3.20 | 0.83 |
| Beryll | 0.83 | |
| Wismuth | 9.8 | 0.12 |
| Borax | 1.70 - 1.80 | 1 |
| Bor | 2.32 | 1.29 |
| Kadmium | 8.65 | 0.25 |
| Kalzit, 0 - 37 °C | 0.79 | |
| Kalzit, 0 - 100 °C | 0.83 | |
| Kalzium | 4.58 | 0.62 |
| Kohlenstoff | 1.80 - 2.100 | 0.71 |
| Karborund | 0.66 | |
| Kassiterit | 0.37 | |
| Zement, trocken | 1.54 | |
| Zement, Pulver | 0.83 | |
| Holzkohle | 1 | |
| Kupferkies | 0.54 | |
| Chrom | 7.1 | 0.5 |
| Ton | 1.80 - 2.60 | 0.92 |
| Kohle | 0.64 - 0.93 | 1.08 - 1.54 |
| Kobalt | 8.9 | 0.46 |
| Beton, fest | 0.79 | |
| Betonschlacke | 0.75 | |
| Kupfer | 8.80 - 8.95 | 0.37 |
| Korund | 0.41 | |
| Diamant | 3.51 | 0.62 |
| Dolomit | 2.9 | 0.92 |
| Fluorit | 0.92 | |
| Flussspat | 0.87 | |
| Galenit | 0.2 | |
| Pyroxylin-Kunststoff | 1.42 - 1.59 | |
| Quarz, 12,8 - 100 °C | 2.50 - 2.80 | 0.79 |
| Quarz, 0 °C | 0.71 | |
| Steinsalz | 0.92 | |
| Gummi | 2 | |
| Sandstein | 2.00 - 2.60 | 0.92 |
| Serpentin | 2.70 - 2.80 | 1.08 |
| Seide | 1.38 | |
| Silber | 10.40 - 10.60 | 0.25 |
| Natrium | 0.97 | 1.25 |
| Stahl | 7.8 | 0.5 |
| Stein | 0.83 | |
| Steinzeug | 0.79 | |
| Talk | 2.60 - 2.80 | 0.87 |
| Teer | 1.2 | 1.46 |
| Tellur | 6.00 - 6.24 | 0.2 |
| Zinn | 7.20 - 7.50 | 0.2 |
| Ziegel, hohl | 0.62 | |
| Titan | 4.5 | 0.58 |
| Topas | 0.87 | |
| Wolfram | 19.22 | 0.16 |
| Vanadium | 5.96 | 0.5 |
| Vulkanit | 1.38 | |
| Holz | 0.35 - 0.99 | 1.33 - 2.00 |
| Wolle | 1.32 | 1.38 |
| Sphalerit | 3.90 - 4.20 | 0.46 |
| Zink | 6.90 - 7.20 | 0.37 |
Tabelle 2.15.2 Relative Dichten/spezifische Wärmekapazitäten verschiedener Flüssigkeiten
| Flüssigkeit | Relative Dichte | Spezifische Wärmekapazität kJ/kg °C |
| Azeton | 0.79 | 2.13 |
| Ethylalkohol, 0 °C | 0.789 | 2.3 |
| Ethylalkohol, 40 °C | 0.789 | 2.72 |
| Methylalkohol, 4 - 10 °C | 0.796 | 2.46 |
| Methylalkohol, 15 - 21 °C | 0.796 | 2.51 |
| Ammoniak, 0 °C | 0.62 | 4.6 |
| Ammoniak, 40 °C | 4.85 | |
| Ammoniak, 80 °C | 5.39 | |
| Ammoniak, 100 °C | 6.19 | |
| Ammoniak, 114 °C | 6.73 | |
| Anilin | 1.02 | 2.17 |
| Benzol | 1.75 | |
| Kalziumchlorid | 1.2 | 3.05 |
| Rizinusöl | 1.79 | |
| Zitrusöl | 1.84 | |
| Diphenylamin | 1.16 | 1.92 |
| Äthyläther | 2.21 | |
| Äthylenglykol | 2.21 | |
| Schweröl | 0.96 | 1.67 |
| Schweröl | 0.91 | 1.84 |
| Schweröl | 0.86 | 1.88 |
| Schweröl | 0.81 | 2.09 |
| Benzin | 2.21 | |
| Glyzerin | 1.26 | 2.42 |
| Kerosin | 2 | |
| Quecksilber | 19.6 | 1.38 |
| Naphtalin | 1.14 | 1.71 |
| Nitrobenzol | 1.5 | |
| Olivenöl | 0.91 - 0.9400 | 1.96 |
| Petroleum | 2.13 | |
| Kaliumhydroxid | 1.24 | 3.68 |
| Flüssigkeit | Relative Dichte | Spezifische Wärmekapazität kJ/kg °C |
| Salzwasser | 1.0235 | 3.93 |
| Sesamöl | 1.63 | |
| Natriumchlorid | 1.19 | 3.3 |
| Natriumhydroxid | 1.27 | 3.93 |
| Sojaöl | 1.96 | |
| Toluol | 0.866 | 1.5 |
| Terpentin | 0.87 | 1.71 |
| Wasser | 1 | 4.18 |
| Xylol | 0.861 - 0.8810 | 1.71 |
Tabelle 2.15.3 Spezifische Wärmekapazität von Gasen und Dämpfen
| Gas oder Dampf | Spezifische Wärmekapazität kJ/kg °C (konstanter Druck) |
| Azeton | 1.31 |
| Luft, trocken, 0 °C | 1 |
| Luft, trocken,10 0 °C | 1.01 |
| Luft, trocken, 200 °C | 1.03 |
| Luft, trocken, 300 °C | 1.05 |
| Luft, trocken, 400 °C | 1.07 |
| Luft, trocken, 500 °C | 1.09 |
| Alkohol, C2 H5 OH | 1.66 |
| Alkohol, CH3 OH | 1.53 |
| Ammoniak | 1.76 |
| Argon | 0.3 |
| Benzol, C6 H6 | 0.98 |
| Brom | 0.19 |
| Kohlendioxid | 0.62 |
| Kohlenmonoxid | 0.71 |
| Kohlenstoffdisulfid | 0.55 |
| Chlor | 3.43 |
| Chloroform | 0.54 |
| Äther | 1.95 |
| Chlorwasserstoff | 0.56 |
| Wasserstoff | 10 |
| Schwefelwasserstoff | 0.79 |
| Methan | 1.86 |
| Stickstoff | 0.71 |
| Stickoxid | 0.69 |
| Stickstoffdioxid | 4.59 |
| Distickstoffoxid | 0.69 |
| Sauerstoff | 0.65 |
| Sattdampf, 0,5 bar abs | 1.99 |
| Sattdampf, 2 bar abs | 2.13 |
| Sattdampf, 10 bar abs | 2.56 |
| Dampf, 0,5 bar abs, 150 °C | 1.95 |
| Dampf, 2 bar abs, 200 °C | 2.01 |
| Dampf, 10 bar abs, 250 °C | 2.21 |
| Schwefeldioxid | 0.49 |
